★★★
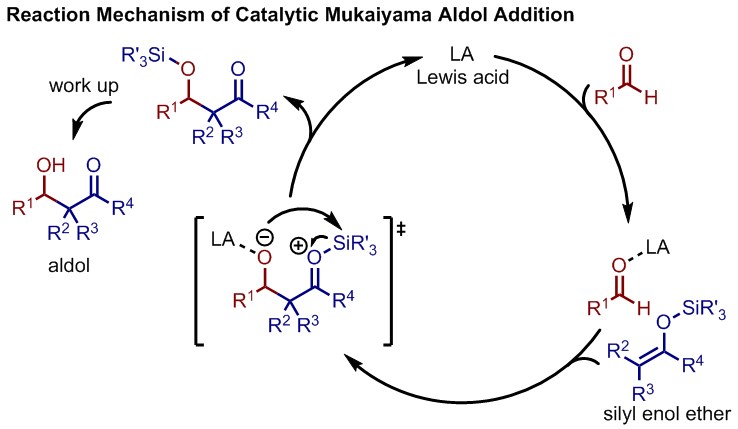
向山アルドール反応は、シリルエノールエーテルをカルボニル化合物に対して、ルイス酸の存在下で求核攻撃させるアルドール反応である。シリルエノールエーテルは安定なエノラート種であるため、交差アルドール反応における自己縮合などの副反応を抑制できる。
化学の教育サイト
★★★
向山アルドール反応は、シリルエノールエーテルをカルボニル化合物に対して、ルイス酸の存在下で求核攻撃させるアルドール反応である。シリルエノールエーテルは安定なエノラート種であるため、交差アルドール反応における自己縮合などの副反応を抑制できる。
反応の概要

反応機構



演習問題1
シリルエノールエーテルは、トリエチルアミンなどの塩基存在下で、カルボニル化合物とシリルクロリド(R3SiCl)を反応させることで合成できる。今、ブチロフェノンとトリメチルシリルクロリドからシリルエノールエーテルを合成し、これとベンズアルデヒドを用いて向山アルドール反応を行った。このとき生成する化合物を立体化学を示しながらすべて描け。また、各化合物がどの程度生成するか議論せよ。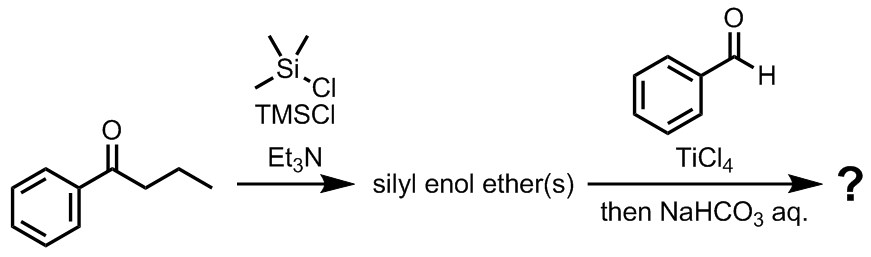
演習問題2
一般に向山アルドール反応において、アルデヒド由来のシリルエノールエーテルを用いることは容易ではない。この理由について、下に示す反応の生成物を示しながら説明し、問題となる反応を抑制する方法について考察せよ。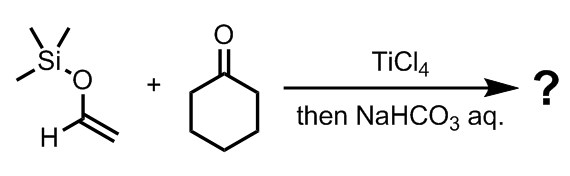
演習問題3
『機構解説』の(D)に示したように、ブレンステッド酸を用いた向山アルドール反応も多く報告されている。しかし、これらの反応ではブレンステッド酸のプロトンが求電子剤のカルボニル基を活性化しているのではないと考えられている。複数の報告に基づけば、これらの反応において真の触媒種として働いているのは、R3Si-Nu (シリル基とブレンステッド酸の共役塩基が結合した化合物)であると考えられている。例えば下に示すように、Me3SiOTfはルイス酸として働いて向山アルドール反応を触媒することが知られている。このMe3SiOTfは、シリルエノールエーテルとTfOHから反応系中で合成することもできる。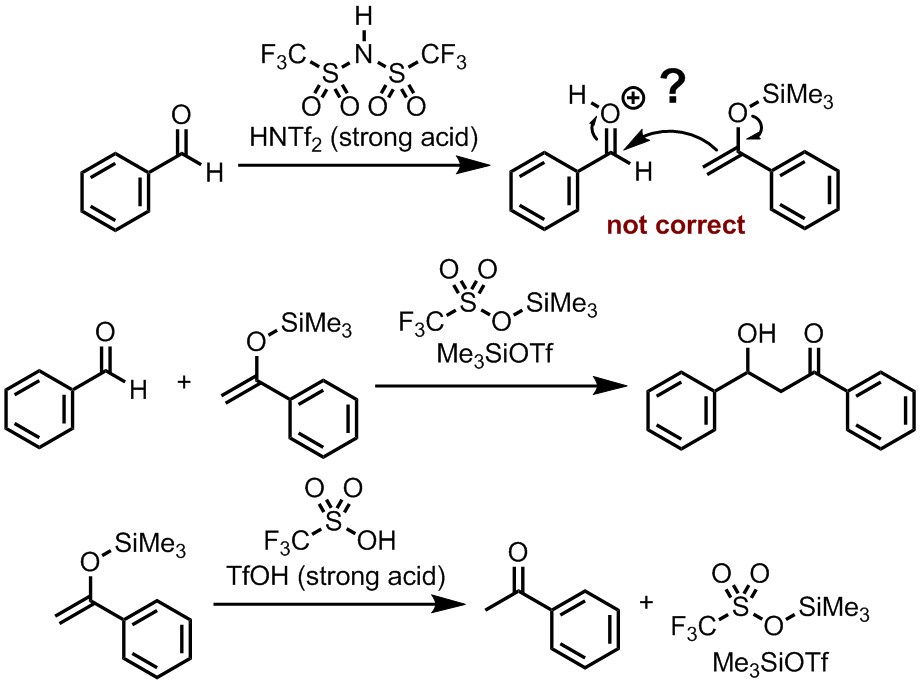
関連記事
外部リンク