★★★
交差アルドール反応は、異なる種類のカルボニル化合物同士で選択的に行うアルドール反応である。求電子剤(ドナー)となるカルボニル化合物のα-水素を、強塩基により先に脱プロトン化した後に、求核剤(アクセプター)となるカルボニル化合物を加えることで、古典的なアルドール反応では難しかった生成物の構造・立体的な制御を可能としている。
反応の概要
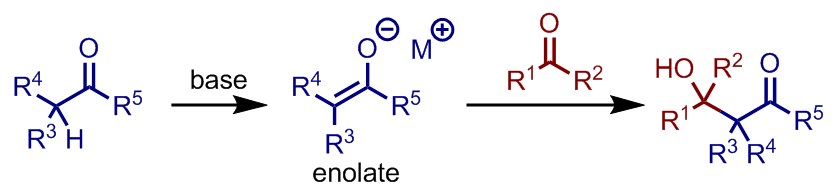
異種のカルボニル化合物同士をアルドール反応させることを、交差アルドール反応という。
古典的アルドール反応にて、異種のカルボニル化合物同士を反応させようとするとき、両者ともにα-水素を持っていると複数の生成物が生じることがある。これは、どちらのカルボニル化合物からもエノール・エノラートが生じうるためで、反応基質におけるpKaの差が十分にないと選択的な合成は難しく、エナンチオマーやジアステレオマーのせいで目的物の単離も困難となることが多い。
そこで、先に求核剤(ドナー)としたいカルボニル化合物を強塩基により脱プロトン化して、金属エノラートを発生させた後に求電子剤(アクセプター)とするカルボニル化合物に求核攻撃させることで、両者からエノラートが生じることを防ぐことができる。
また、金属エノラートを形成させる際に、金属カチオンとして(HSAB則でいう)ハードなもの、かつルイス酸性が高いものを使うと、反応の遷移状態の構造が六員環遷移状態と呼ばれるものをとり、高いジアステレオ選択性を発現させることができる場合もある。
特に、エノラートの中でも安定なシリルエノラートを形成させ、これをルイス酸存在下で交差アルドール反応を行うものを向山アルドール反応という。また、オキサゾリジノンといった不斉補助基を用いた立体選択的交差アルドール反応をエヴァンス(Evans)アルドール反応という。このように交差アルドール反応は、多様な炭素–炭素結合を形成できるのみならずジアステレオ選択的にアルコールを導入できるために、合成反応として価値が高く多数の派生形が開発されている。
反応機構
反応機構自体は塩基を用いたアルドール反応と同じである。まずα-水素をもつカルボニル化合物が強塩基により脱プロトン化されエノラートとなる。ここに求電子剤となるカルボニル化合物を加えることで、求電子剤がエノラートになることを防ぎつつ、求核攻撃によって炭素–炭素結合を形成しアルコキシドを得る。両者のカルボニル化合物のpKaの差によって、反応が円滑に進行する場合と副生成物が無視できない量生じてしまう場合に分かれる。一般に、求電子剤と比較してpKaの小さい酸性度の高いプロトンをもつ化合物を求核剤として用いる場合には、目的の交差アルドール反応が進行しやすい。一方でpKaの差がほとんどない、あるいは求電子剤のpKaの方が小さい場合には、求核攻撃よりも酸・塩基反応の方が先に進行して、意図しないアルドール反応がおこることがある。ただしこのような場合でも、全ての反応剤を同時に添加する古典的アルドールよりは幾分反応の選択性は良い。
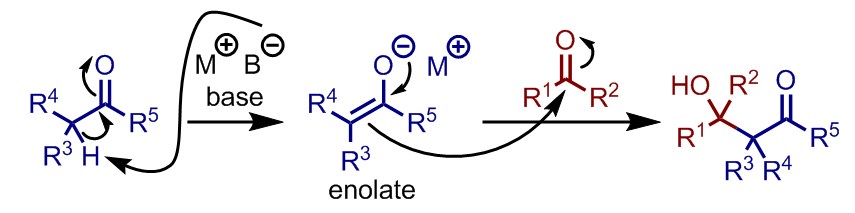
交差アルドール反応において重要な点として、そのジアステレオ選択性がある。エノラートを形成させる際に、Li+などのハードなルイス酸性を有するカチオンを用いていると、生じたエノラートと求電子剤であるカルボニル化合物が、ルイス酸を介した六員環遷移状態と呼ばれる構造を形成しやすくなる。この六員環遷移状態は一般に椅子型配座をとり、立体反発が最小になるように形成されることから、反応のジアステレオ選択性が制御され、比較的簡単に生成物の立体を予想できるようになる。なお、キラル源がない場合にはエナンチオ選択性は生じないことには注意されたい(図中点線枠内)。
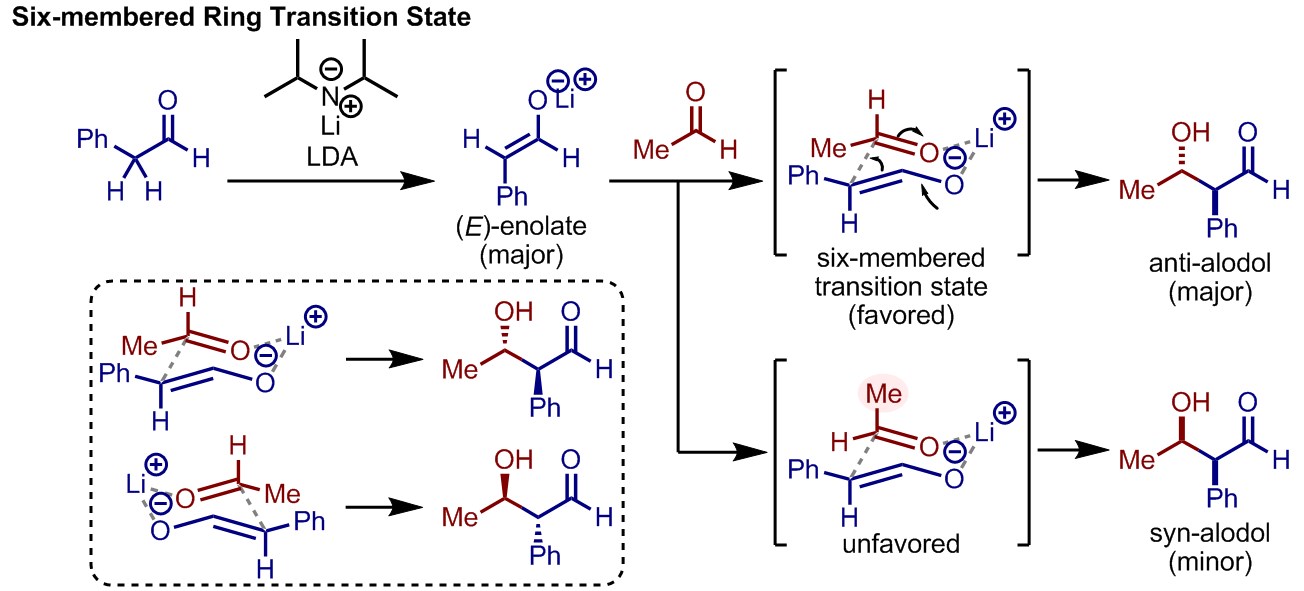
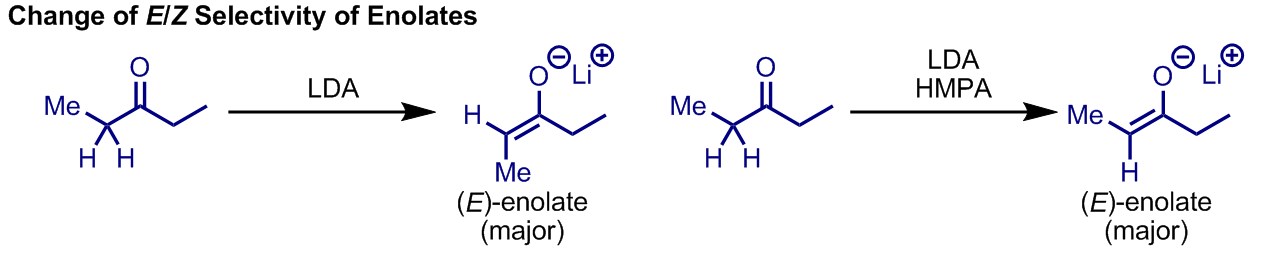
リチウムエノラートが形成する際、エノラートにはE体とZ体が考えられるが、一般的なリチウムイオンを有する強塩基(多くの場合LDAが用いられる)を用いた場合にはE体が生じる。ただしHMPAなどを添加するとZ体エノラートが生成しやすくなり、反応のジアステレオ選択性が変化することがある。
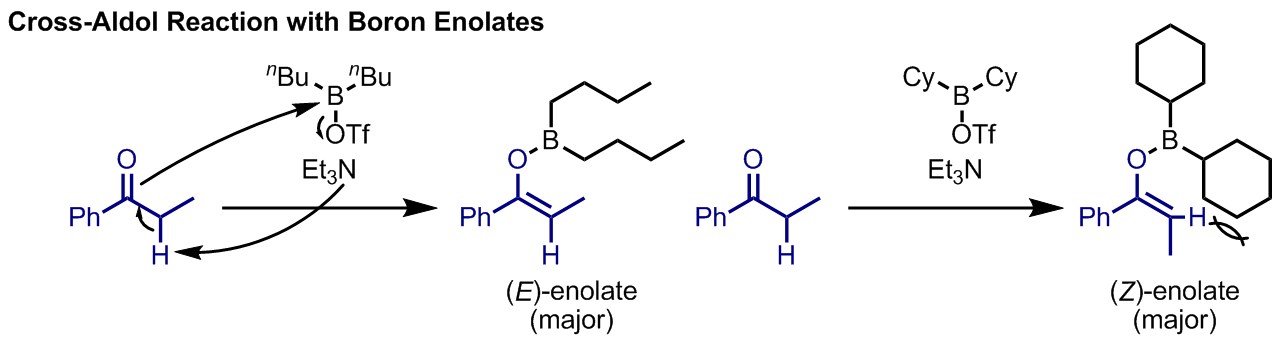
ホウ素エノラートは、ホウ素がリチウムよりも強いルイス酸として働くことから、リチウムエノラートを用いた時よりも高いジアステレオ選択性を与える傾向がある。また用いるホウ素試薬上の置換基によって、エノラートのE/Z選択性を制御することも可能である。ホウ素エノラートを用いたアルドール反応で、キラルオキサゾリジノンを不斉補助基としてもつ基質を用いるエナンチオ選択的反応を開発者の名前からエヴァンス(Evans)アルドール反応という。
ケイ素エノラート(シリルエノールエーテル)は他のエノラートと比較して極めて安定であり、合成と単離が比較的容易である。このシリルエノールエーテルをルイス酸とともに用いるアルドール反応は開発者の名前から向山アルドール反応と呼ばれる。
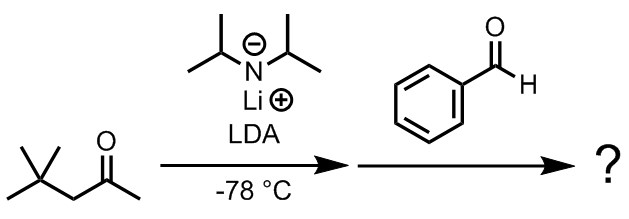
演習問題1
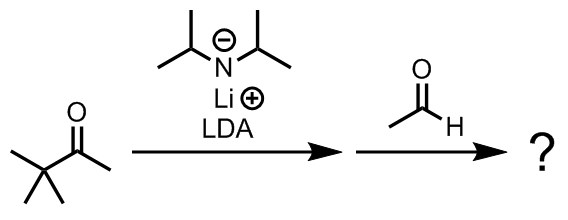
4,4-ジメチルペンタン-2-オンに対してLDAを反応させた後、ベンズアルデヒドを加えた。六員環遷移状態を考えて、ジアステレオ選択性に注意しながら主生成物を示せ。なお、このケトンには複数の種類のプロトンが存在するが、脱プロトン化のされやすさには差がある。この理由について考察せよ。
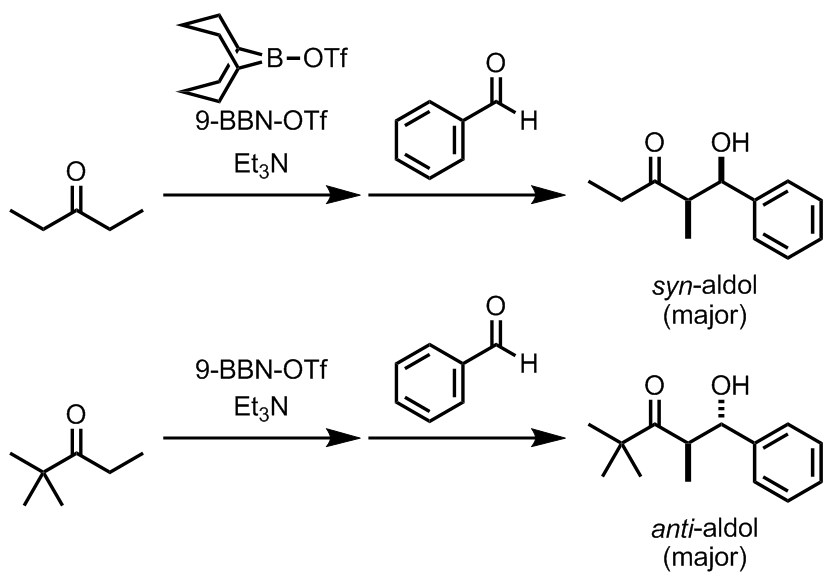
演習問題2
ホウ素エノラートは、ホウ素の置換基によってそのE/Z選択性を制御できる。しかし、基質によってもそのE/Z選択性は制御され得る。例えばこの反応では、どちらも同じホウ素試薬である9-BBN-OTfという化合物を用いているが、生成物のジアステレオ選択性は異なっている。この理由を、反応中間体であるホウ素エノラートのE/Zから考察せよ。
演習問題3
交差アルドール反応では、求核剤となるカルボニル化合物に強塩基を加えて、先にエノラートを形成することで副反応を抑制している。しかし、pKaに差がある化合物では、いくら先にエノラートを形成させたとしても、酸塩基反応によって本来求電子剤となるカルボニル化合物が脱プロトン化されてしまう可能性がある。
この反応について、目的とする交差アルドール反応による生成物と、考えられる副反応による生成物を示せ。このとき副反応がどれくらい進行しやすいかについて、基質のpKaから議論せよ。さらに、この副反応を抑制して目的の反応を進行させる方法を考察せよ。