★★★
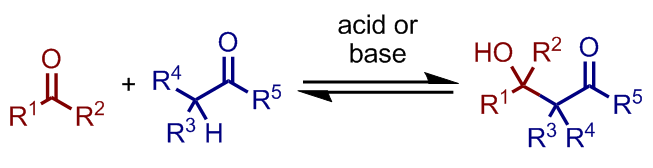
アルドール反応は、炭素–炭素結合を形成する有機反応の一つである。α水素をもつカルボニル化合物から生じたエノール、またはエノラートが、アルデヒドまたはケトンのカルボニル位と反応してβ-ヒドロキシカルボニル化合物が生じる。
反応の概要
アルドール反応は有機反応としては極めて古典的な反応で、1869年にアレクサンドロ・ボロディン(Alexander Borodin, Алекса́ндр Бороди́н)によって発見された。
アルドール反応は酸条件・塩基条件のどちらでも進行しうる。α-位に水素を持つカルボニル化合物が酸によってエノール化、あるいは塩基によってエノラート化し、このα-炭素が他のカルボニル基に対して求核攻撃することで炭素–炭素結合が形成される。
生成物は、求核攻撃されたカルボニル基がアルコールとなったβ-ヒドロキシカルボニル化合物であり、これが脱水すると不飽和カルボニル化合物となる。この段階まで反応が進行する場合はアルドール縮合と称される。
一般にアルドール反応ではエノール・エノラートの生成が必要であるため、α-水素を持たないカルボニル化合物やホルムアルデヒドのような化合物が求核剤となることはない。従って、一方がα-水素をもつカルボニル化合物、他方がα-水素を持たない化合物であった場合、生成物は(脱水と副反応を考えなければ)一通りに定まる。しかし、反応剤の両者がα-水素をもつカルボニル化合物であった場合には、どちらがエノール・エノラートになるかで複数の生成物が考えられる。このようなアルドール反応を、交差アルドール反応と呼ぶ。
また、生成するβ-ヒドロキシカルボニル化合物は多くの場合キラリティをもつ。このため、様々な工夫により生成物のキラリティを制御する不斉アルドール反応が知られている。特に天然物にキラル中心を導入する際に、複数の官能基を導入しつつキラル中心を構築できるため、不斉アルドール反応は現在でも盛んに研究されている。
反応機構
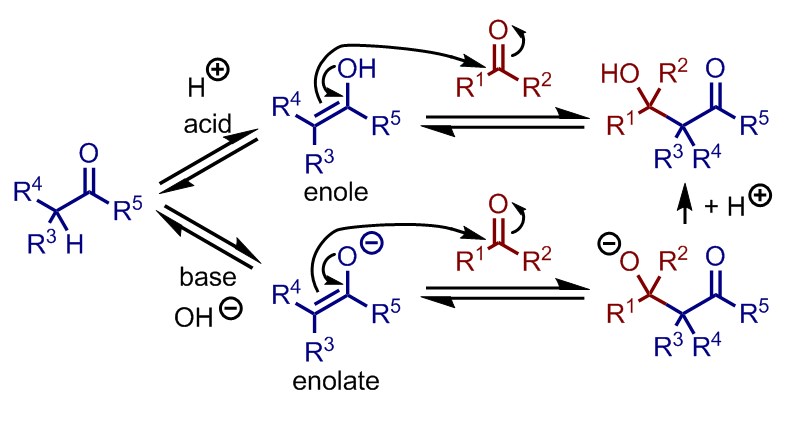
酸触媒を用いる場合にはまず、α-水素をもつカルボニル化合物がケト-エノール互変異により一部がエノールとなる。このエノールのヒドロキシ基からの電子の押し込みにより、α-炭素が他方のカルボニル炭素に求核攻撃をする。求核攻撃を受けたカルボニルはアルコールとなる。
一方塩基触媒を用いる場合には、α-水素が脱プロトン化によりエノラートとなる点で異なるが、反応機構自体はほぼ同一である。生成物はアルコキシドとなり、場合によってはアルコキシドとケトン部位で金属カチオン等を介した相互作用がある。
アルドール反応に限らずカルボニル基への求核攻撃は、カルボニル炭素上の反結合性軌道に求核剤の電子が入ることで進行するため、この位置(ビュルギ-ダニッツ角度)が立体的な要因などによりふさがれていて、求核剤が近づけない場合には反応は進行しない。
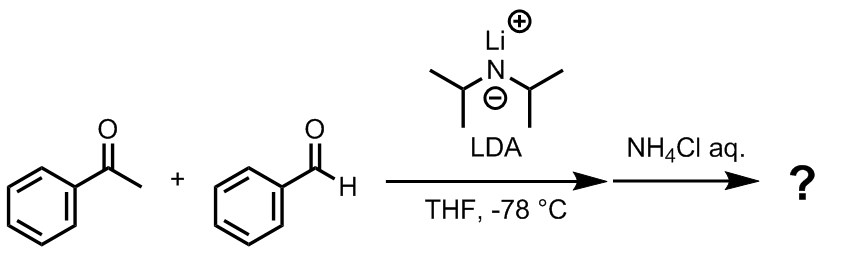
演習問題1
アセトフェノンとベンズアルデヒドを用いて、求核性の低い強塩基の存在下にアルドール反応を行ったときの主生成物は何か。
主生成物が複数考えられる場合はそれぞれを示し、立体化学も明示すること。
演習問題2
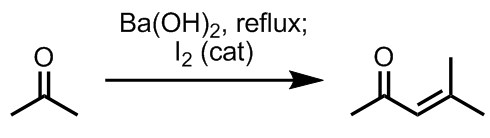
アセトンを水酸化バリウムなどの強塩基存在下で加熱し、最後にヨウ素を触媒量加えるとメシチルオキシドが生成する。
反応機構を示せ。
演習問題3
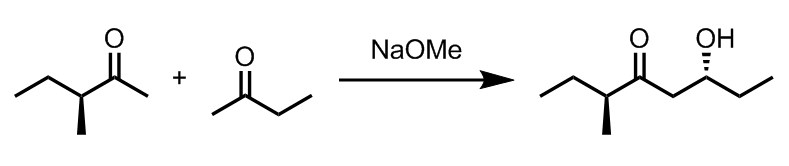
アルドール反応は、炭素–炭素結合を形成しつつ、アルコールを導入することができるため有用であるものの、現実はそれほど甘くはない。
ある人は下図のような反応により目的物を得ようと考え、二種のカルボニル化合物を混合した後に、ナトリウムメトキシドを加えた。
しかし反応後に分析してみると、多数の生成物が混在した苦しい状態となっており、収率も低くとどまった。
この反応で考えられる生成物をできるだけ考え、それらの中でもどれが多く生成するかを議論せよ。